肿瘤是威胁人类健康和生命的重大疾病。对于有机会接受手术的患者来说,切除肿瘤病灶通常是首选治疗方法。但是术后复发是肿瘤切除治疗后需要解决的最大挑战之一。伤口愈合过程及相关的炎症也会导致肿瘤术后复发。目前,化疗和放疗在临床上常用于控制术后复发,但在某些情况下,这些方法往往具有较强的毒副作用。因此,迫切需要安全有效的治疗方法来控制肿瘤术后复发。
肿瘤术后复发的原因主要由局部肿瘤微浸润和循环肿瘤细胞引起,它们不仅以多种方式抑制先天免疫反应,还促进肿瘤细胞从浸润的免疫效应微环境中逃逸。此外,伤口愈合过程及相关的炎症可导致手术局部区域出现免疫抑制微环境,随后出现全身免疫抑制状态,帮助肿瘤细胞实现免疫逃逸并加速复发。癌症免疫治疗近些年迅速发展,在这些方法或药物中,有些能够消除肿瘤细胞的免疫逃逸并直接诱导抗肿瘤免疫;其中一些方法在控制肿瘤术后复发和转移方面具有潜在价值。因此,肿瘤免疫疗法在预防术后复发方面应具有巨大的潜在应用价值。
系统给药的免疫疗法,如免疫检查点抑制剂、CAR-T,或CAR-NK细胞疗法,主要用于实现全身长期有效的免疫监视。研究表明,瘤内免疫治疗比全身治疗更安全,有时效果也更好。在肿瘤部位进行局部集中治疗可以打破局部免疫耐受,诱导全身抗肿瘤免疫,同时避免严重副作用。因此,原位免疫激活是肿瘤免疫治疗和预防术后复发的一种很有前景的策略。另一个重要的点是伤口愈合和炎症在肿瘤切除的瞬间就开始了。因此,为了有效控制术后复发,应尽早诱导免疫激活。此外,术后伤口愈合并非短时间过程;因此,最理想的方式是能够在术后即刻实施原位免疫调节并使其维持一定时间。
溶瘤病毒疗法是癌症免疫疗法中一个极具前景的分支,其利用的是具有抗肿瘤作用的病毒,这些病毒能够选择性地在肿瘤组织中复制并将其溶解,同时不损害正常组织。除了对肿瘤细胞产生直接的溶瘤作用外,溶瘤病毒还能够诱导全身性的抗肿瘤免疫反应,从而将“冷”肿瘤转变为“热”肿瘤。这一结果提高了肿瘤对其他治疗方式的敏感性,从而为协同抗肿瘤策略提供了机会。在所有类型的溶瘤病毒中,腺病毒、单纯疱疹病毒和痘苗病毒是过去十年中在临床试验中被广泛研究的三种溶瘤病毒,表明它们在未来极具应用潜力。
在最新的研究中,南京大学医学院吴俊华/江春平团队设计并实现了溶瘤病毒(腺病毒adv、单纯疱疹病毒HSV或痘苗病毒VV)始于术中的在手术原位的持续释放。在乳腺癌原位小鼠模型中,肿瘤切除后立即原位植入adv@Nap gel可以持续性激活抗肿瘤免疫,控制肿瘤术后复发。此外,他们还将这一概念扩展到包括其他类型的病毒载体(HSV和VV),并在人源化小鼠肿瘤模型中验证了相关 结果。这些发现为控制肿瘤术后复发方法的开发提供了重要的治疗策略和理论基础。
这项研究首先利用4T1原位乳腺癌小鼠模型中研究Ⅴ型溶瘤腺病毒(adv)激活抗肿瘤免疫反应的能力,以评估其在预防肿瘤术后复发方面的潜力。结果表明,这种溶瘤疗法能够通过激活记忆性T细胞引发全身性的抗肿瘤免疫反应,这为其后续应用于控制肿瘤术后复发方面提供了支持。
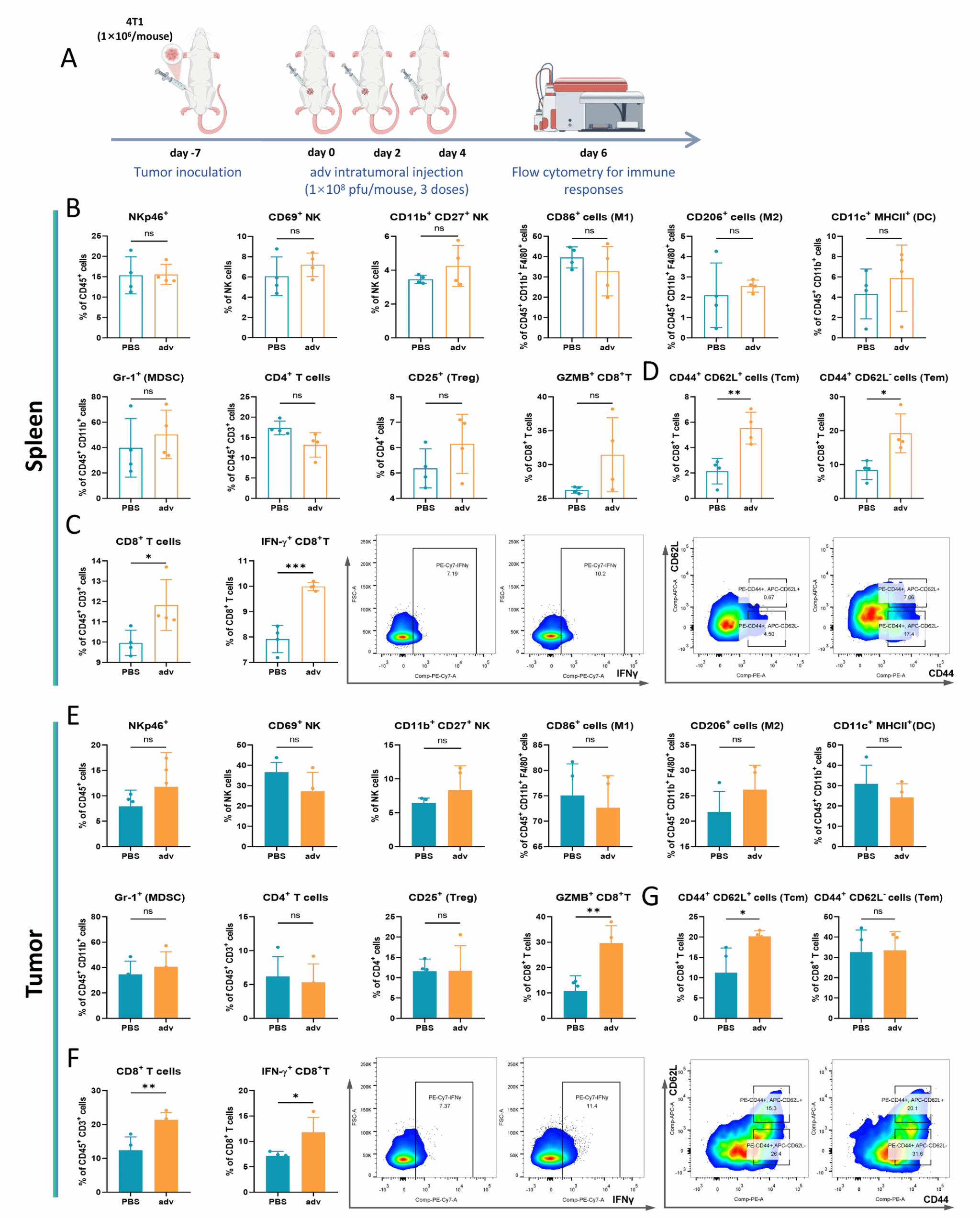
图1. 溶瘤腺病毒adv在原位乳腺癌模型中的抗肿瘤免疫调节作用。
腺病毒adv激活免疫记忆反应是其能够抑制肿瘤术后复发的潜在能力的前提条件。为了解决在肿瘤组织被移除后溶瘤病毒原位治疗不可行的问题,团队采用了能够在体内实现局部药物输送的自组装多肽水凝胶系统(NapGFFYK hydrogel),该系统保证了水凝胶基质随时间逐渐降解而实现溶瘤病毒的原位持续释放。adv@Nap gel的机械稳定性对于其作为病毒载体的应用至关重要。流变学特性的检测证明adv@Nap gel可在体外或体内持续保持机械稳定性。PCR及TCID50证明adv@Nap gel可在体外或体内持续释放adv,并维持病毒的感染活性。
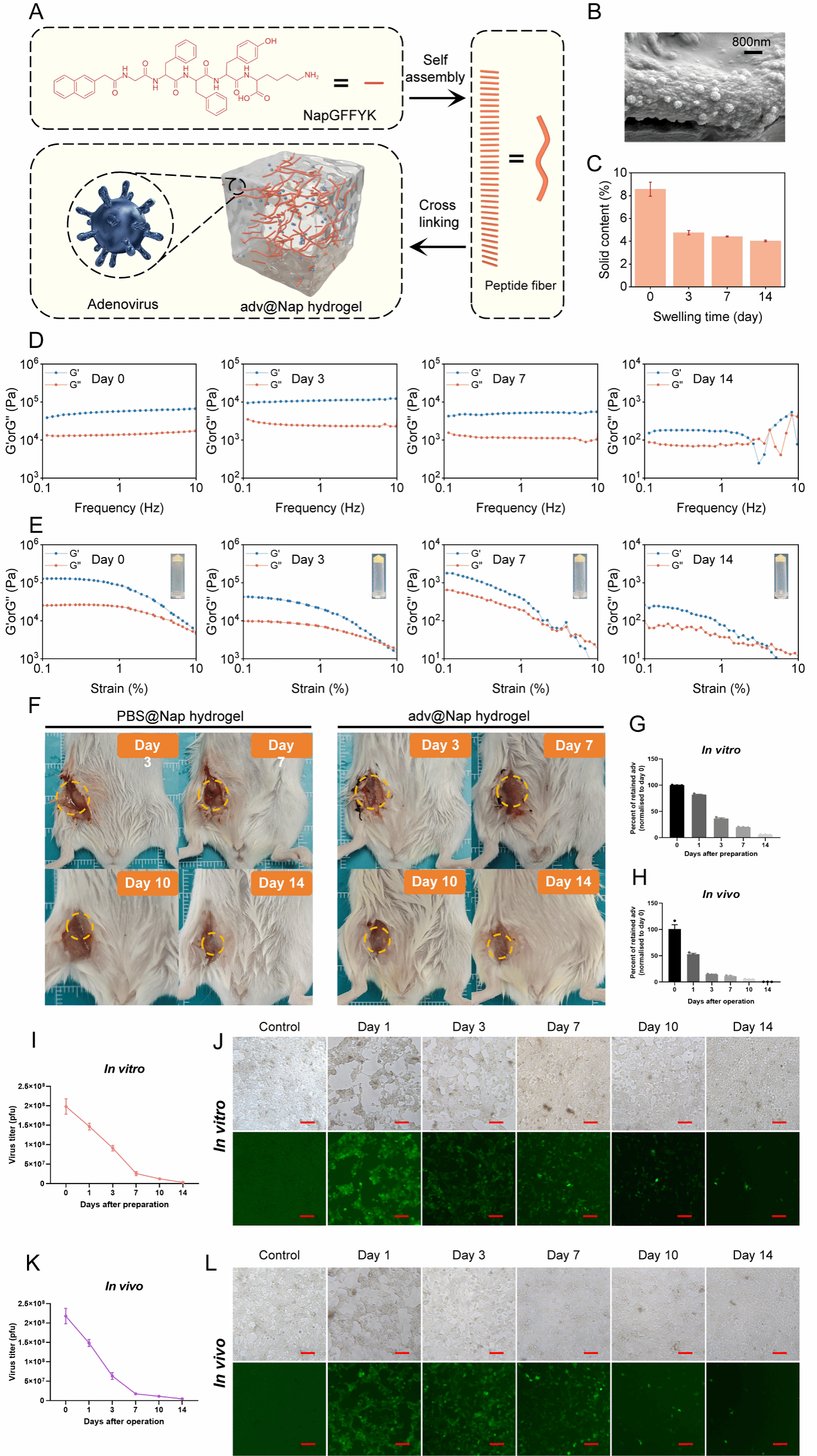
图2 溶瘤腺病毒adv从adv@Nap gel中释放是一个稳定而缓慢的过程。
研究团队紧接着检测了adv@Nap gel对肿瘤术后复发的抑制效果。使用4T1细胞构建小鼠原位乳腺癌复发模型,在手术切除肿瘤后立即在原位放置adv@Nap gel,通过体内成像系统(IVIS)每周监测肿瘤复发情况。结果证实adv@Nap gel在对小鼠无明显毒性的前提下,可有效控制肿瘤术后复发,延长小鼠生存期,且对伤口愈合没有明显影响。
紧接着,为了探讨adv@Nap gel抑制肿瘤术后复发和延长生存期的机制,团队分析了adv@Nap gel治疗小鼠的免疫反应。流式细胞术和免疫组化结果证实,始于术中原位放置adv@Nap gel可显著激活先天免疫和适应性免疫应答,诱导长期和肿瘤抗原特异性免疫应答,同时诱导持久的免疫记忆,最终抑制肿瘤术后复发和转移。
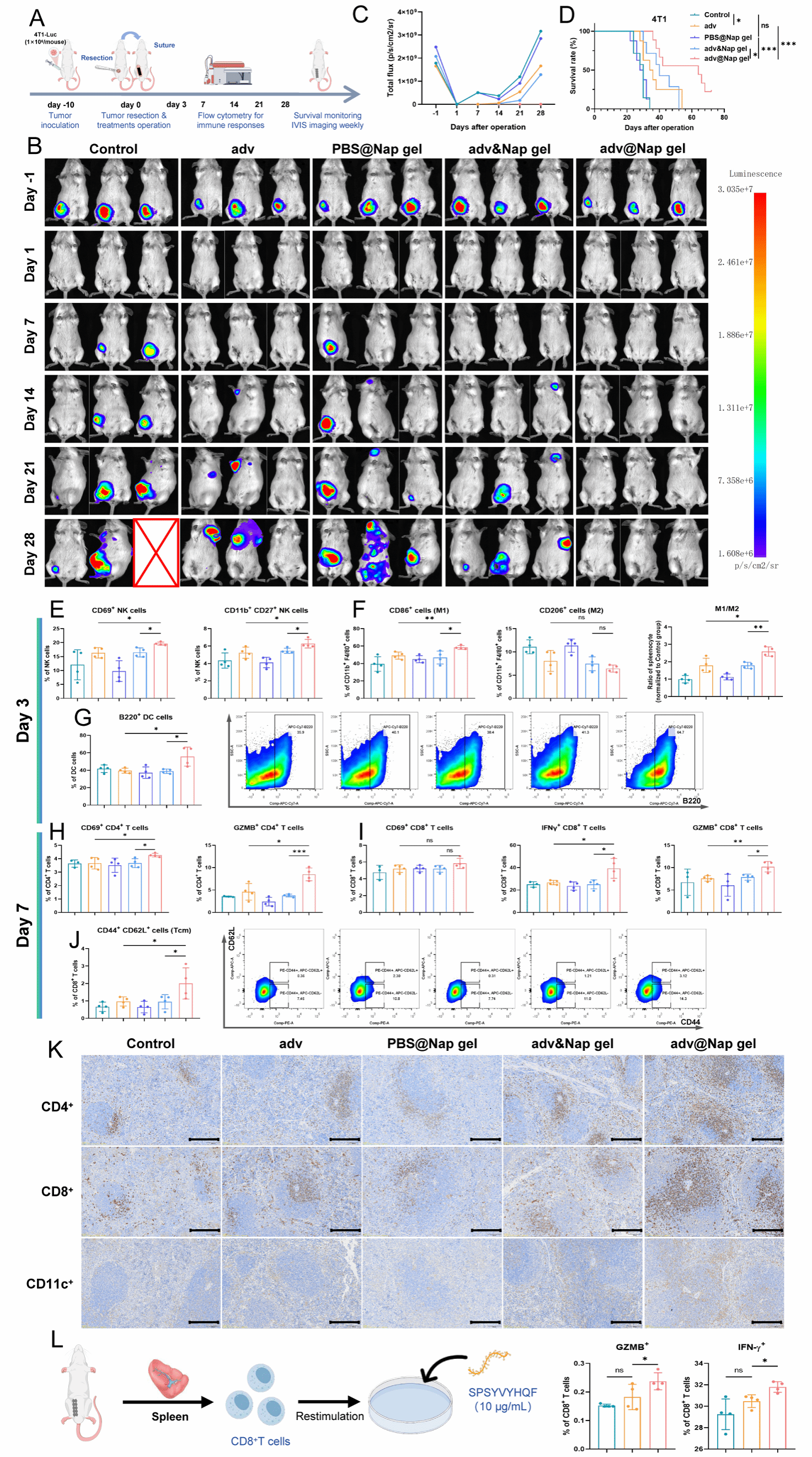
图3 始于术中原位放置adv@Nap gel可以控制肿瘤复发和转移,激活抗肿瘤免疫反应。
实验证明溶瘤腺病毒介导的始于术中的原位延续性抗肿瘤免疫活化表现为:显著上调的I型干扰素通路相关细胞因子IFN-α和IFN-β的表达,以及趋化因子IL-15、CXCL-9和CXCL-10的显著释放;I型干扰素通路下游的JAK-STAT通路的显著活化。抗体阻断实验进一步证实IFNAR及多种免疫细胞对于溶瘤腺病毒介导的始于术中的原位延续性抗肿瘤免疫活化用于控制肿瘤术后复发的必要性。这些结果表明,溶瘤腺病毒始于术中的原位延续性释放可诱导显著的全身I型干扰素通路激活和免疫趋化。
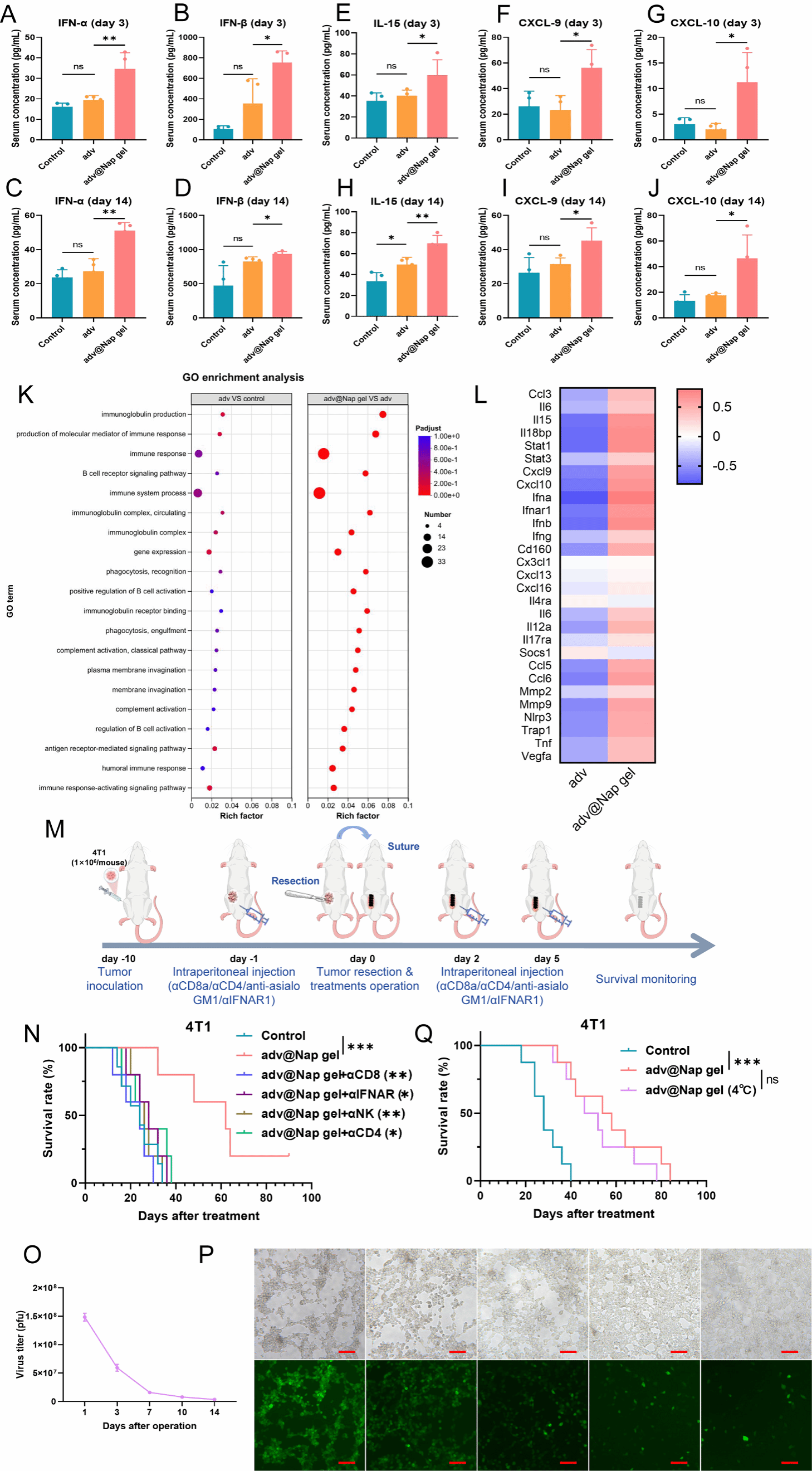
图4 原位放置adv@Nap gel可诱导I型干扰素通路活化和免疫趋化。
随后,团队对adv@Nap gel始于术中和原位放置的必要性进行了验证,通过不同给药时间和不同给药方式的对比以及免疫活化的检测,证实了始于术中的在手术原位放置adv@Nap gel对成功控制肿瘤术后复发至关重要。
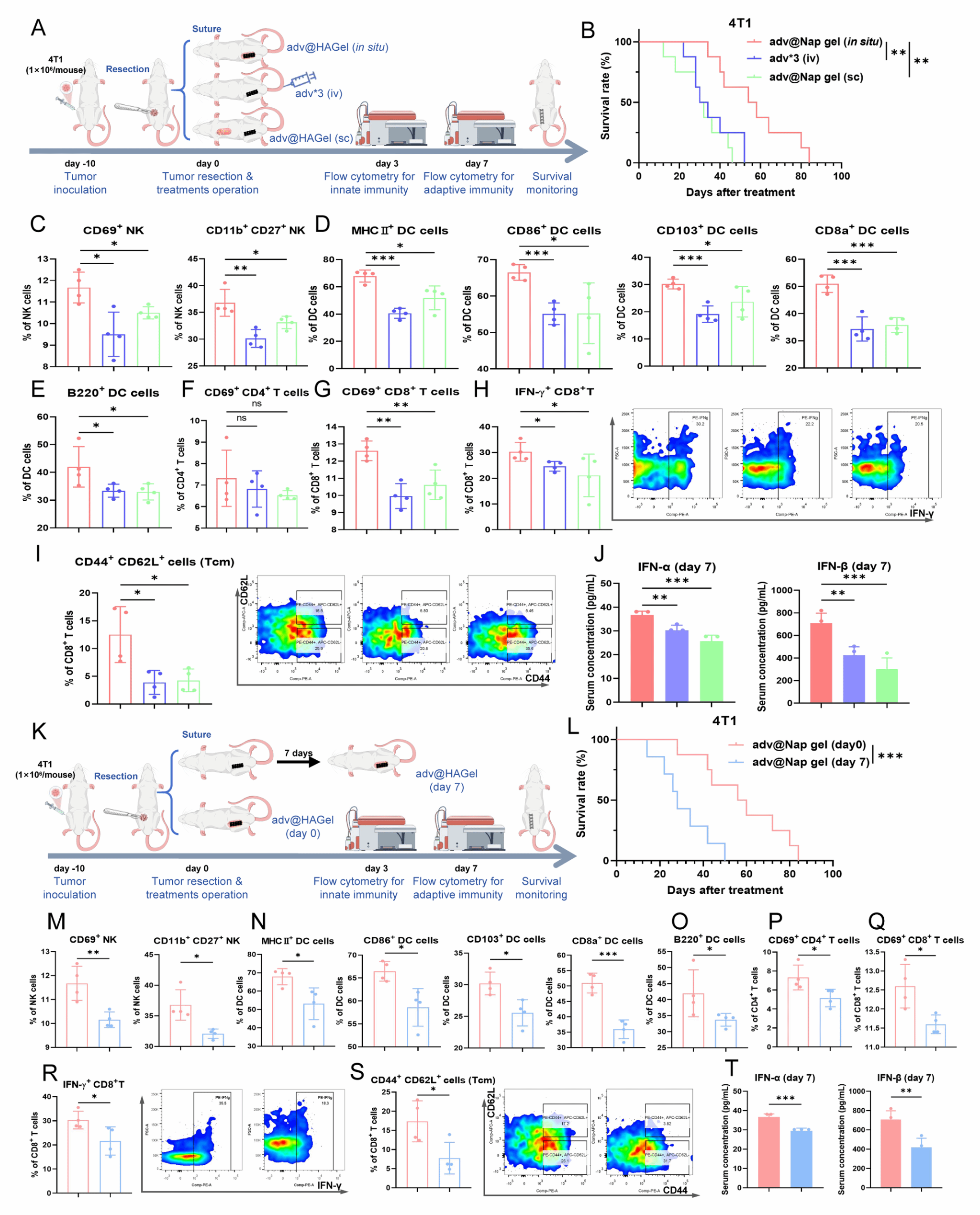
图5 始于术中和原位给药对于adv@Nap gel诱导免疫激活以控制肿瘤术后复发的必要性。
团队还评估了这一持续释放平台能否广泛适用于除adv之外的其他溶瘤病毒。结果证实HSV@Nap gel或VV@Nap gel始于术中的原位释放都可以显著激活先天免疫和适应性免疫应答,并形成免疫记忆,控制肿瘤术后复发,延长小鼠生存期。这些结果极大地拓展了溶瘤病毒始于术中的原位延续性释放在抗肿瘤免疫治疗中的应用前景。
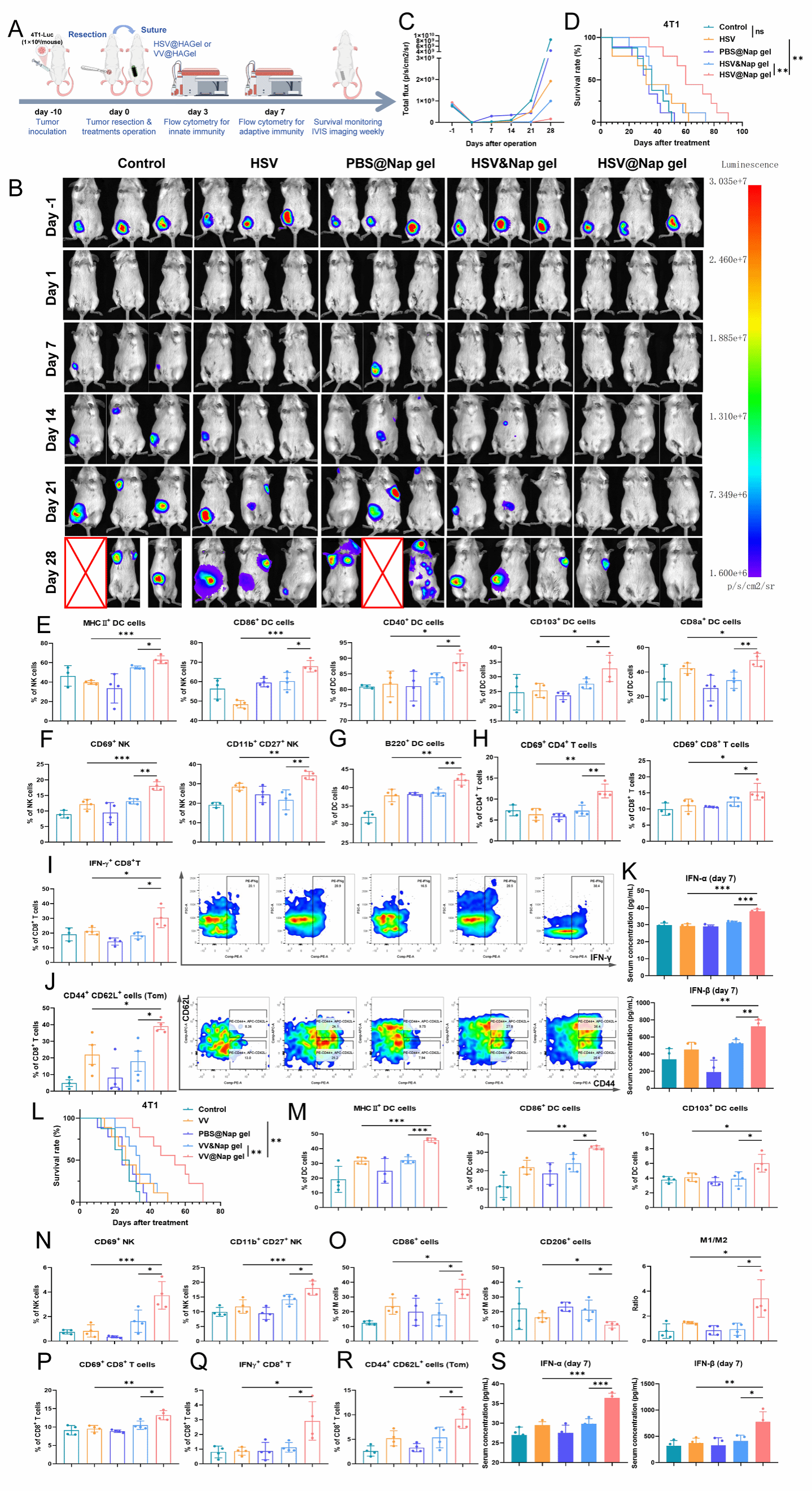
图6 始于术中原位放置HSV@Nap gel或VV@Nap gel可以控制肿瘤复发和转移。
最后,为了验证前期研究成果转化为临床实践的可行性,团队在其他肿瘤模型中进行了验证。在B16F10细胞构建的黑色素瘤模型中,始于术中原位放置adv@Nap gel可有效控制肿瘤术后复发,延长小鼠生存。同样,该治疗还激活了先天性和适应性免疫反应,最终诱导了免疫记忆的形成。
团队使用MDA-MB-231在免疫系统人源化小鼠中成功构建了具有高度临床相关性的三阴性乳腺癌(TNBC)原位模型。,证实了在肿瘤切除后立即植入adv@Nap gel可以诱导抗肿瘤免疫反应和I型干扰素通路的激活,并在手术后控制肿瘤复发,展现了巨大的临床转化前景。
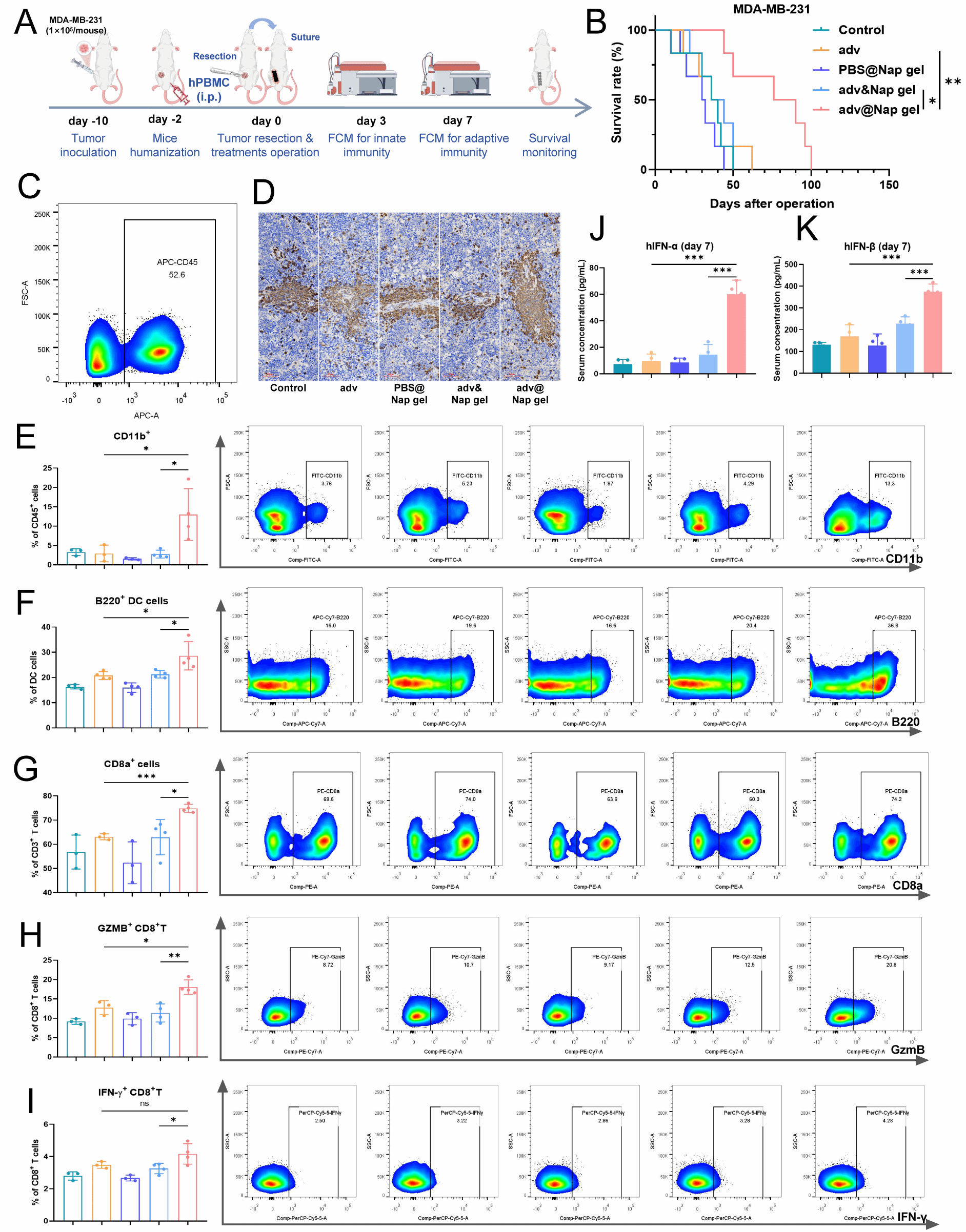
图7 在免疫系统人源化的小鼠模型中,始于术中原位放置adv@Nap gel原位治疗可控制肿瘤复发。
在本研究中,团队实现了溶瘤病毒(adv、HSV或VV)始于术中的手术原位的持续释放。这一治疗方式能迅速激活I型干扰素通路,诱导先天性和适应性免疫反应应答,控制肿瘤术后复发和转移,并延长小鼠存活时间。团队验证了使用adv@Nap gel进行即时原位治疗能够抑制肿瘤术后复发的能力。值得注意的是,附载在Nap gel中的HSV或VV也能控制肿瘤术后复发。
因此,这些研究结果表明,免疫治疗的及时性和手术原位持续的抗肿瘤免疫激活对肿瘤切除术的预后有着显著的影响,为免疫疗法在处理术后复发方面的临床应用提供了理论依据,为临床控制术后复发提供了一种重要的治疗选择。
近日,南京大学医学院吴俊华教授/江春平教授团队在Cell Reports Medicine上发表了题为“In situ extended immune activation instantly after tumor resection by oncolytic virus controls postoperative tumor recurrence”的研究论文。南京大学医学院博士生过慈良和南京大学物理学院博士生高天等人为该研究论文的共同第一作者。南京大学医学院顾晓松院士、江春平教授和吴俊华教授为该论文的共同通讯作者。
该研究得到了省重点科技项目(编号202502)、省自然科学基金(编号ZR2025MS1306)、省实验室项目(编号SYS202202)、国家自然科学基金(编号81972888,82272819)、省实验室科研项目(编号JNL-2025008B,JNL-2025009B,JNL-2025011B,JNL-2025010B,JNL2025012B,JNL-2023017D)和省重点研发计划(编号BE2022840)的资助。
原文链接:https://doi.org/10.1016/j.xcrm.2025.102399
